Χορήγηση
Το Metalyse 25mg είναι πλέον διαθέσιμο για ενήλικες για τη θρομβολυτική θεραπεία του οξέος ισχαιμικού Αγγειακού Εγκεφαλικού Επεισοδίου εντός 4,5 ωρών από τον τελευταίο γνωστό χρόνο χωρίς σημεία και συμπτώματα του τρέχοντος εγκεφαλικού επεισοδίου κατόπιν αποκλεισμού ενδοκρανιακής αιμορραγίας.1
Γιατί κάθε λεπτό μετράει

Εφάπαξ ενδοφλέβια χορήγηση bolus
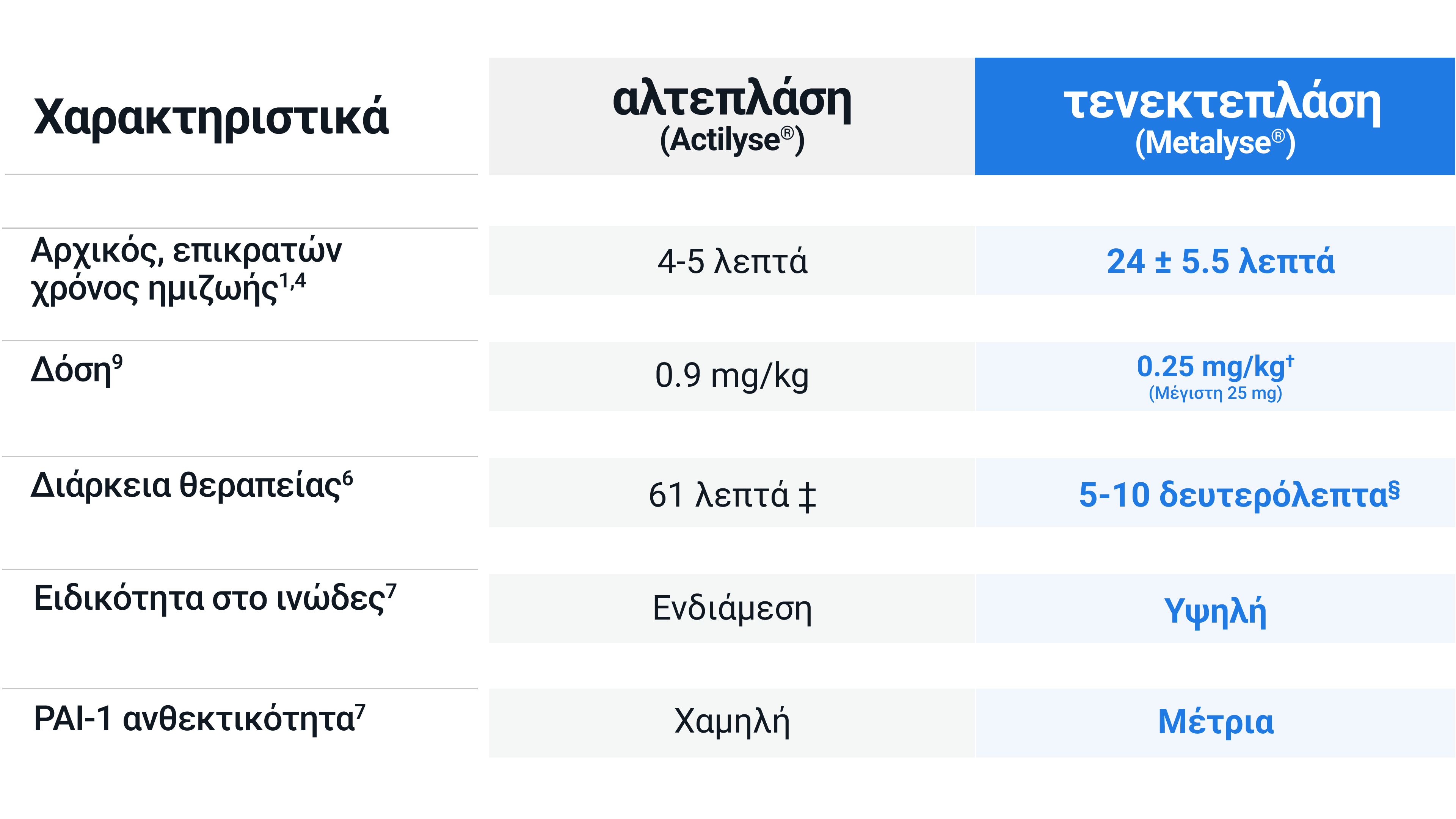
Το Metalyse® 25 mg χορηγείται με εφάπαξ ενδοφλέβια bolus δόση σε διάστημα 5 έως 10 δευτερολέπτων, εξαλείφοντας την ανάγκη για ενδοφλέβια έγχυση μίας ώρας, όπως απαιτείται για το Actilyse®2-3
Το Μetalyse® 25 mg διατίθεται σε ένα μόνο φιαλίδιο σκόνης για ανασύσταση.
Η δοσολογία για το Metalyse® 25 mg βασίζεται σε 5 βαθμίδες με βάση το σωματικό βάρος:
| Σωματικό Βάρος | Αντίστοιχος όγκος του ανασυσταθέντος διαλύματος (ml) | Τενεκτεπλάση (Μονάδες) | Τενεκτεπλάση (mg) |
|---|---|---|---|
| < 60 | 3 | 3000 | 15 |
| ≥ 60 έως < 70 | 3.5 | 3500 | 17.5 |
| ≥ 70 έως < 80 | 4 | 4000 | 20 |
| ≥ 80 έως <90 | 4.5 | 4500 | 22.5 |
| ≥ 90 | 5 | 5000 | 25 |
Γιατί το Metalyse® 25 mg είναι πιο γρήγορο και πιο εύκολο στη χρήση σε σύγκριση με το Actilyse®;
Η τενεκτεπλάση είναι μια γενετικά τροποποιημένη έκδοση της αλτεπλάσης. Μεταλλάξεις στην αλληλουχία της πρωτεΐνης αύξησαν την ειδικότητα του Metalyse® (τενεκτεπλάση) στο ινώδες και την κατέστησαν πιο ανθεκτική στους φυσικούς αναστολείς, γεγονός που αύξησε τον χρόνο ημιζωής της και επέτρεψε μικρότερη διάρκεια θεραπείας.
Υποσημειώσεις
-
†
Η τενεκτεπλάση χορηγήθηκε εντός 4.5 ωρών μετά την έναρξη των συμπτωμάτων του εγκεφαλικού επεισοδίου, ως ενδοφλέβεια bolus δόση με βάση 0,25 mg/kg για το μέγιστο βάρος σε κάθε βαθμίδα: < 60 kg, 15 mg τενεκτεπλάση; ≥ 60 έως < 70 kg, 17,5 mg; ≥ 70 έως < 80 kg, 20 mg; ≥ 80 έως <90 kg, 22,5 mg; και ≥ 90 kg, 25 mg.
-
‡
10% bolus σε 1 λεπτό, το υπόλοιπο εγχύεται σε 60 λεπτά6
-
§
Εφάπαξ 5 δευτερόλεπτα bolus6
-
Ινωδολυτική θεραπεία του οξέος ισχαιμικού εγκεφαλικού επεισοδίου (εντός 4.5 ωρών από τον τελευταίο γνωστό χρόνο χωρίς σημεία και συμπτώματα του τρέχοντος εγκεφαλικού επεισοδίου και κατόπιν αποκλεισμού ενδοκρανιακής αιμορραγίας με κατάλληλη απεικονιστική τεχνολογία
Βιβλιογραφία
-
Metalyse® European Summary of Product Characteristics.
-
Menon BK, et al. Lancet 2022; 400:161-169.
-
Bivard A, et al. Lancet Neurol. 2022; 21:520-27.
-
Actilyse® European Summary of Product Characteristics.
-
Dancsecs K. A. et al. Am J Emerg Med. 2021; 47:90-94.
-
Miller, SE and Warach, SJ. Neurotherapeutics 2023; 20:664–678.
-
Zhu A, et al. Res Pract Thromb Haemost. 2022; 6:e12795.
MET(07/2025) PC-GR-102541

Για τις εγκεκριμένες ενδείξεις, τις ανεπιθύμητες ενέργειες, τις προειδοποιήσεις, τις αντεδείξεις, την δοσολογία, και οποιαδήποτε άλλη πληροφορία παρακαλούμε ανατρέξτε στην Περίληψη των Χαρακτηριστικών του Προϊόντος (ΠΧΠ)
