Προφίλ ασφάλειας
Το Metalyse 25mg είναι πλέον διαθέσιμο για ενήλικες για τη θρομβολυτική θεραπεία του οξέος ισχαιμικού Αγγειακού Εγκεφαλικού Επεισοδίου εντός 4,5 ωρών από τον τελευταίο γνωστό χρόνο χωρίς σημεία και συμπτώματα του τρέχοντος εγκεφαλικού επεισοδίου κατόπιν αποκλεισμού ενδοκρανιακής αιμορραγίας.1
Γιατί κάθε λεπτό μετράει

Στην κλινική δοκιμή AcT φάσης ΙΙΙ, δεν παρατηρήθηκε διαφορά στο προφίλ ασφαλείας της τενεκτεπλάσης* σε σύγκριση με αυτό της αλτεπλάσης για τη θεραπεία του οξέος ισχαιμικού Αγγειακού Εγκεφαλικού Επεισοδίου†2
Στην κλινική δοκιμή AcT, ο κίνδυνος για τα κύρια ανεπιθύμητα συμβάντα, συμπεριλαμβανομένου του θανάτου εντός 90 ημερών και της συμπτωματικής ενδοεγκεφαλικής αιμορραγίας, ήταν παρόμοιος για την τενεκτεπλάση σε σύγκριση με την αλτεπλάση. Η τενεκτεπλάση ήταν επίσης παρόμοια με την αλτεπλάση όσον αφορά το ποσοστό των πρόσθετων εκβάσεων ασφάλειας, συμπεριλαμβανομένου του αιμορραγικού εμφράγματος και της ενδοκρανιακής, υπαραχνοειδούς και ενδοκοιλιακής αιμορραγίας2
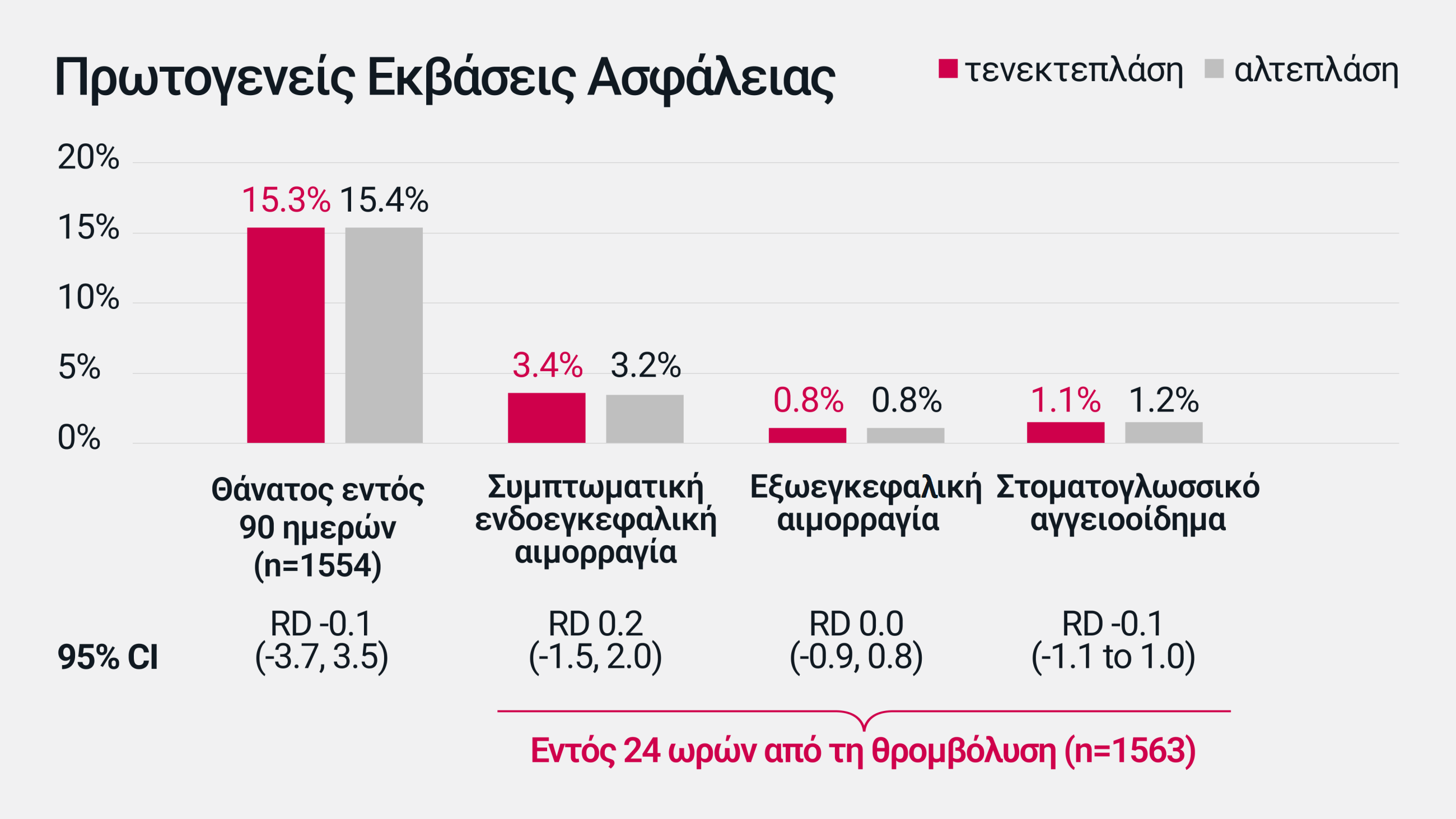
Ο πίνακας αυτός έχει δημιουργηθεί από την Boehringer lngelheim με βάση την αναφορά Menon BK, et al. Lancet 2022; 400:161-169.
Η AcT ήταν μια πολυκεντρική, ανοικτή, παράλληλων ομάδων, συνδεδεμένη με μητρώο, τυχαιοποιημένη ελεγχόμενη δοκιμή (RCT), στην οποία 1600 ασθενείς εντάχθηκαν από 22 πρωτοβάθμια και ενιαία κέντρα εγκεφαλικών επεισοδίων σε ολόκληρο τον Καναδά και τους χορηγήθηκε τυχαία τενεκτεπλάση (ως δόση bolus σύμφωνα με το σωματικό βάρος, με βάση τα 0,25 mg/kg ΣΒ, έως 25 mg το μέγιστο, n=816) ή αλτεπλάση (0,9 mg/kg ΣΒ έως 90 mg το μέγιστο, n=784). Συμπεριλήφθηκαν ασθενείς 18 ετών και άνω, με διάγνωση ισχαιμικού εγκεφαλικού επεισοδίου που προκαλεί νευρολογικό έλλειμμα οδηγώντας σε αναπηρία, οι οποίοι προσήλθαν εντός 4,5 ωρών από την έναρξη των συμπτωμάτων και ήταν επιλέξιμοι για θρομβόλυση σύμφωνα με τις Καναδικές κατευθυντήριες οδηγίες. Η πρωταρχική έκβαση στην AcT ήταν η βαθμολογία mRS 0-1 στις 90-120 ημέρες μετά τη θεραπεία, η οποία αξιολογήθηκε μέσω τυφλής ανασκόπησης στον πληθυσμό που είχε πρόθεση θεραπείας.2
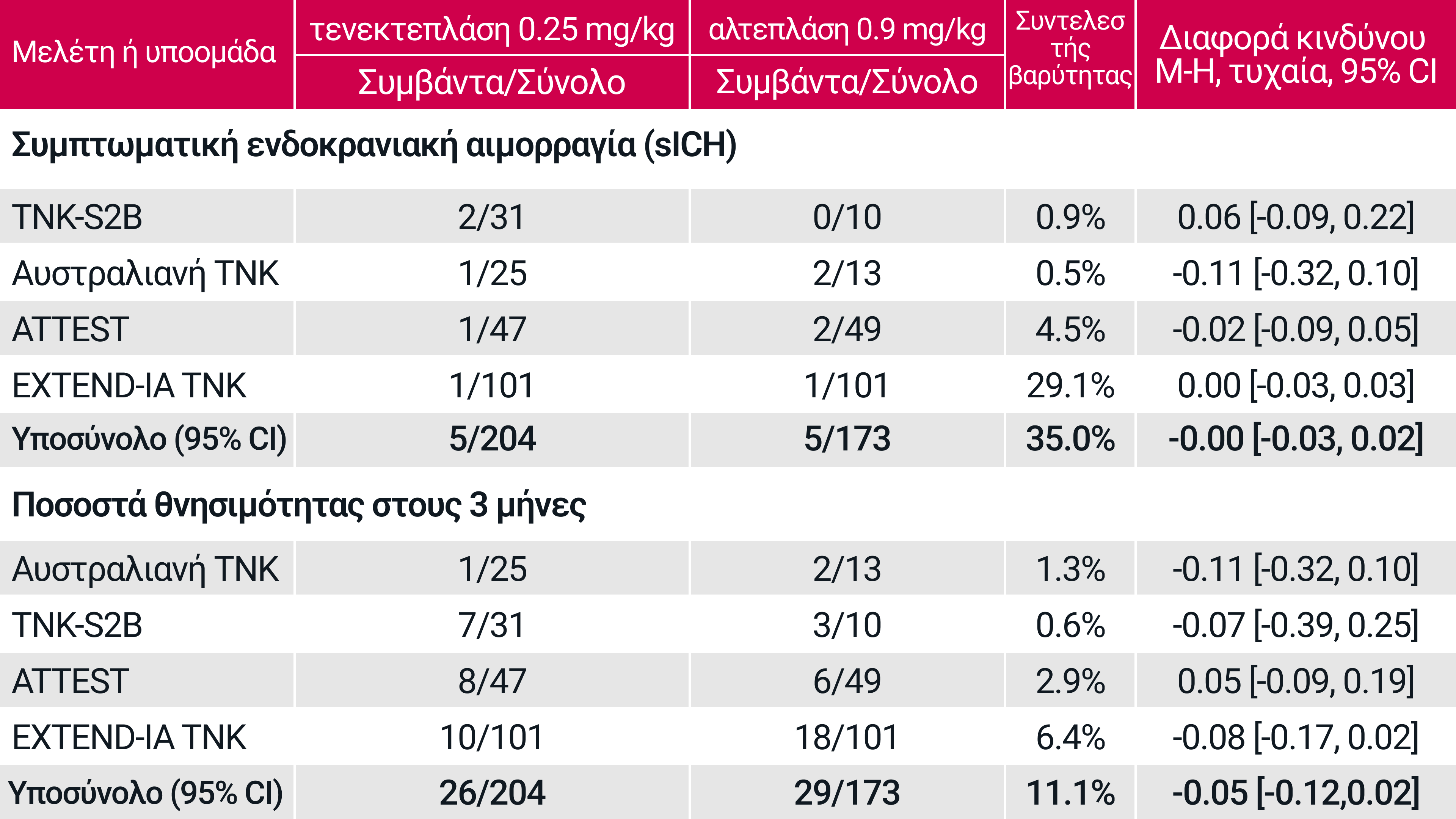
Ο παρών πίνακας δημιουργήθηκε από την Boehringer Ingelheim με βάση την αναφορά. Buigos A. M. and Saver j. L. Stroke 2019; 50:2156-2162. (Συμπλήρωμα) Η μελέτη Nor-Test δεν περιλαμβάνεται επειδή εξέτασε μόνο την Tenecteplase 0,4mg.
Μια μετα-ανάλυση 5 RCTs έδειξε επίσης παρόμοια αποτελέσματα ασφάλειας για την τενεκτεπλάση έναντι της αλτεπλάσης στη θεραπεία του οξέος ισχαιμικού Αγγειακού Εγκεφαλικού Επεισοδίου‡3
Πραγματοποιήθηκε συστηματική βιβλιογραφική αναζήτηση και μετα-ανάλυση σύμφωνα με τις κατευθυντήριες οδηγίες PRISMA, προσαρμοσμένες στην ανάλυση μη κατωτερότητας. Η πρωταρχική έκβαση ήταν η απαλλαγή από την αναπηρία (βαθμολογία mRS, 0-1) σε διάστημα 3 μηνών και αναλύθηκαν πρόσθετες εκβάσεις αποτελεσματικότητας και ασφάλειας. Η συστηματική ανασκόπηση εντόπισε 5 μελέτες στις οποίες συμμετείχαν 1585 ασθενείς (τενεκτεπλάση =828, αλτεπλάση=757). Οι ασθενείς με αλτεπλάση έλαβαν την τυπική δοσολογία 0,9 mg/kg ΣΒ, ενώ η δοσολογία της τενεκτεπλάσης ήταν 0,1 mg/kg ΣΒ στο 6,8%, 0,25 mg/kg ΣΒ στο 24,6% και 0,4 mg/kg ΣΒ στο 68,6% των συμμετεχόντων.3
Συχνότητα ανεπιθύμητων ενεργειών.
| Κατηγορία/οργανικό σύστημα | Ανεπιθύμητη ενέργεια |
|---|---|
| Διαταραχές του ανοσοποιητικού συστήματος | |
| Σπάνιες | Αναφυλακτοειδείς αντιδράσεις (περιλαμβανομένων εξανθήματος, κνίδωσης, βρογχόσπασμου, οιδήματος του λάρυγγα) |
| Διαταραχές του νευρικού συστήματος | |
| Πολύ συχνές | Ενδοκρανιακή αιμορραγία (όπως εγκεφαλική αιμορραγία, εγκεφαλικό αιμάτωμα, αιμορραγικό εγκεφαλικό επεισόδιο, αιμορραγική εξέλιξη εγκεφαλικού επεισοδίου, ενδοκρανιακό αιμάτωμα, υπαραχνοειδής αιμορραγία) περιλαμβανομένων των σχετιζόμενων συμπτωμάτων όπως υπνηλία, αφασία, ημιπάρεση, σπασμοί |
| Οφθαλμικές διαταραχές | |
| Όχι συχνές | Αιμορραγία του οφθαλμού |
| Καρδιακές διαταραχές | |
| Σπάνιες | Αιμορραγία του περικαρδίου |
| Αγγειακές διαταραχές | |
| Πολύ συχνές | Αιμορραγία |
| Σπάνιες | Εμβολή (θρομβωτικός εμβολισμός) |
| Διαταραχές του αναπνευστικού συστήματος, του θώρακα και του μεσοθωράκιου | |
| Συχνές | Επίσταξη |
| Σπάνιες | Πνευμονική αιμορραγία |
| Διαταραχές του γαστρεντερικού | |
| Συχνές | Αιμορραγία του γαστρεντερικού σωλήνα (όπως γαστρορραγία, αιμορραγία γαστρικού έλκους, αιμορραγία του ορθού, αιματέμεση, μέλαινα, αιμορραγία του στόματος) |
| Όχι συχνές | Οπισθοπεριτοναϊκή αιμορραγία (όπως οπισθοπεριτοναϊκό αιμάτωμα) |
| Μη γνωστές | Ναυτία, έμετος |
| Διαταραχές του δέρματος και του υποδόριου ιστού | |
| Συχνές | Εκχύμωση |
| Διαταραχές των νεφρών και των ουροφόρων οδών | |
| Συχνές | Αιμορραγία της ουροποιογεννητικής οδού (όπως αιματουρία, αιμορραγία των ουροφόρων οδών) |
| Γενικές διαταραχές και καταστάσεις της οδού χορήγησης | |
| Συχνές | Αιμορραγία του σημείου της ένεσης, αιμορραγία του σημείου παρακέντησης |
| Παρακλινικές εξετάσεις | |
| Σπάνιες | Αρτηριακή πίεση μειωμένη |
| Μη γνωστές | Θερμοκρασία του σώματος αυξημένη |
| Κακώσεις, δηλητηριάσεις και επιπλοκές θεραπευτικών χειρισμών | |
| Μη γνωστές | Εμβολή από λίπος, η οποία ενδέχεται να οδηγήσει σε αντίστοιχες συνέπειες στα σχετιζόμενα όργανα |
| Χειρουργικοί και άλλοι ιατρικοί χειρισμοί | |
| Μη γνωστές | Μετάγγιση |
Ο πίνακας είναι προσαρμοσμένος απο ΠΧΠ
Οι ομάδες συχνοτήτων ορίζονται σύμφωνα με την ακόλουθη σύμβαση: πολύ συχνές (≥ 1/10), συχνές (≥ 1/100 έως < 1/10), όχι συχνές (≥ 1/1.000 έως < 1/100), σπάνιες (≥ 1/10.000 έως < 1/1.000), πολύ σπάνιες (< 1/10.000), μη γνωστές (δεν μπορούν να εκτιμηθούν με βάση τα διαθέσιμα δεδομένα).
Υποσημειώσεις
-
*
Η τενεκτεπλάση χορηγήθηκε ως δόση bolus με βάση 0,25 mg/kg για το μέγιστο βάρος σε κάθε βαθμίδα: < 60 kg, 15 mg τενεκτεπλάση; ≥ 60 έως < 70 kg, 17,5 mg; ≥ 70 έως < 80 kg, 20 mg; ≥ 80 έως <90 kg, 22,5 mg; και ≥ 90 kg, 25 mg.2
-
†
Στην κλινική δοκιμή φάσης ΙΙΙ AcT, τα ποσοστά των ανεπιθύμητων ενεργειών ήταν παρόμοια για την τενεκτεπλάση σε σύγκριση με την αλτεπλάση. Τα κυριότερα ανεπιθύμητα συμβάντα ήταν: θάνατος εντός 90 ημερών (15,3% για την τενεκτεπλάση έναντι 15,4% για την αλτεπλάση: RD -0,1 [95% CI -3,7, 3,5]), συμπτωματική ενδοεγκεφαλική αιμορραγία (3,4% έναντι 3,2%: RD 0,2 [95% CI -1,5, 2,0]), εξωκρανιακή αιμορραγία (0,8% έναντι 0,8%: RD 0,0 [95% CI -0,9, 0,8]) και στοματογλωσσικό αγγειοοίδημα (1,1% έναντι 1,2%- RD -0,1 [95% CI -1,1, 1,0]).2
-
‡
Οι εκβάσεις ασφαλείας που αναλύθηκαν ήταν η συμπτωματική ενδοεγκεφαλική αιμορραγία (sICH) και η θνησιμότητα. Τα συμβάντα συμπτωματικής αιμορραγίας στις επιμέρους δοκιμές προσδιορίστηκαν με βάση τον ορισμό sICH που χρησιμοποιήθηκε σε κάθε δοκιμή. Για τη θνησιμότητα και το sICH, τα περιθώρια μη κατωτερότητας ορίστηκαν στο 1%.
-
ΙΑΕΕ = οξύ ισχαιμικό αγγειακό εγκεφαλικό επεισόδιο, CI= διάστημα εμπιστοσύνης, RD= διαφορά κινδύνου, sICH= συμπτωματική ενδοεγκεφαλική αιμορραγία.
-
Ινωδολυτική θεραπεία του οξέος ισχαιμικού αγγειακού εγκεφαλικού επεισοδίου (εντός 4,5 ωρών από τον τελευταίο γνωστό χρόνο χωρίς σημεία και συμπτώματα του τρέχοντος εγκεφαλικού επεισοδίου και κατόπιν αποκλεισμού ενδοεγκεφαλικής αιμορραγίας με κατάλληλη απεικονιστική τεχνολογία.
Βιβλιογραφία
-
Metalyse® European Summary of Product Characteristics.
-
Menon BK, et al. Lancet 2022; 400:161-169.
-
Burgos A. M. and Saver J. L. Stroke 2019; 50:2156-2162.
MET(07/2025) PC-GR-102541

Για τις εγκεκριμένες ενδείξεις, τις ανεπιθύμητες ενέργειες, τις προειδοποιήσεις, τις αντεδείξεις, την δοσολογία, και οποιαδήποτε άλλη πληροφορία παρακαλούμε ανατρέξτε στην Περίληψη των Χαρακτηριστικών του Προϊόντος (ΠΧΠ)
